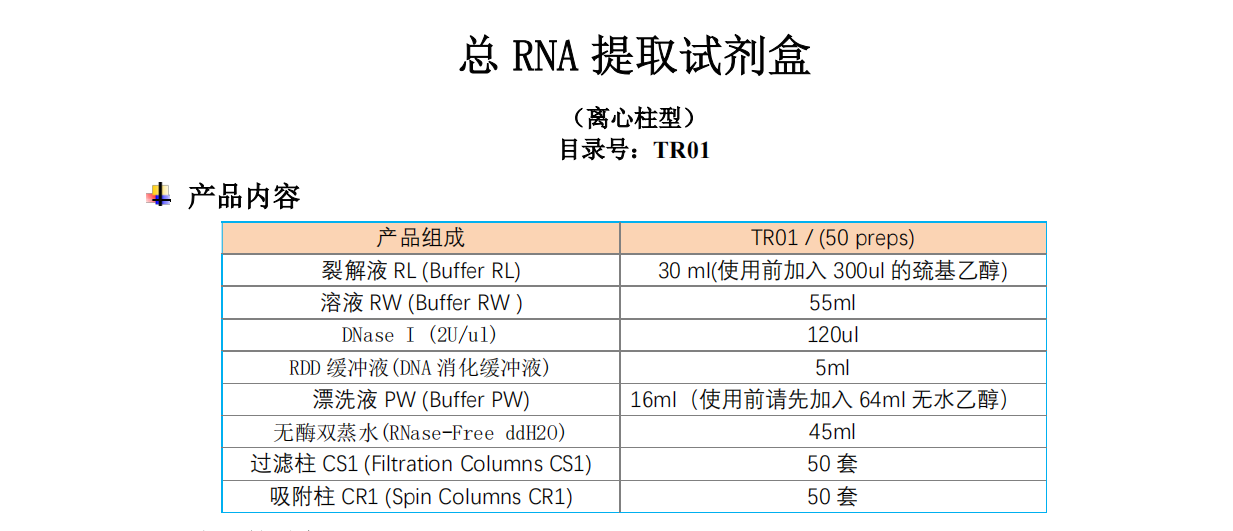
选配的试剂
蛋白酶K(20mg/ml)目录号:GF0202-01,客户自备,提取动物组织总RNA时需配备 溶菌酶(50mg/ml)目录号:GF0203-01,客户自备,提取细菌总RNA 时需配备
 储存条件
储存条件
DNase I溶液(DNase I 冻干粉溶解于专用保存液),储存于-20℃,可反复冻融; 其他试剂室温(15-25℃)保存。
 产品简介
产品简介
总RNA提取试剂盒提供了快速简单且有效的方法,可从各种动物组织、培养细胞及细菌、植物组织、 中提取总RNA。本试剂盒采用离心管柱的方式,配合使用我司独特的硫氰酸胍裂解液,使组织或细胞裂解 及均质化,并加入乙醇使RNA选择性的与管柱膜结合,于操作过程中加入DNase Ⅰ以去除残留的基因组DNA,经过多次“洗涤及离心”的步骤去除污染杂质,再以无核酸酶水回收结合在管柱膜上的RNA。若RNA 小于200nt,如5sRNA、tRNA和microRNA,无法在此系统中被有效地回收。提取的总RNA纯度高,基本没有DNA 和蛋白质污染,可用于PCR、芯片分析、Blot、PolyA 筛选、体外翻译、RNase 保护分析和分子克隆等多种下游实验。
本试剂盒同样适用酵母,可以从酵母菌中提取总RNA,具体操作方法见“附录Ⅰ”。
本试剂盒也可用于将以其他方法提取的 RAN 进行clean up 或去除基因组DNA 污染,详见“附录Ⅱ”。
 预防RNase污染,应注意以下几方面
预防RNase污染,应注意以下几方面
1. 经常更换新手套,因为皮肤经常带有细菌,可能导致RNase污染。
2. 使用无RNase的塑料制品和枪头避免交叉污染。
3. RNA在裂解液RL中时不会被RNase降解。但提取后继续处理过程中应使用不含RNase的塑料和玻璃器皿。玻璃器皿可在150℃烘烤4 h,塑料器皿可在0.5 M NaOH中浸泡10 min,然后用水彻底清洗,再灭菌,即可去除RNase。
4. 配制溶液应使用无RNase的水(将水加入到干净的玻璃瓶中,加入DEPC至终浓度0.1%(V/V),高压灭菌)。
![]() 使用前注意事项
使用前注意事项
1. 使用前请向裂解液RL 添加 350ul 巯基乙醇,添加过巯基乙醇的裂解液 4℃保存。
2. 使用前请向漂洗液PW 添加 64ml 无水乙醇。
3. 为确保RNA 的品质及产量,应尽量收取新鲜的动物组织进行 RNA 提取,或将组织立即以液氮冷冻,储存于-70℃,组织亦可保存在RANstore 样本保存液(目录号:TR38)中。样本保存在 RNAstore 试剂中,可于37℃存放 1 天、4℃存放 1 个月、-20℃永久保存,所提取的 RNA 品质与储存在液氮中相同。
 操作步骤
操作步骤
一、从培养细胞中提取总 RNA
1. 收集细胞
a. 悬浮细胞的收集(收集细胞数量请不要超过 1×107):估计细胞数量,300×g 离心 5 min,将细胞收集到离心管中,仔细吸除所有培养基上清。
b. 单层贴壁细胞的收集(收集细胞数量请不要超过 1×107):可直接在培养容器中裂解(容器直径不超过 10 cm),或者使用胰蛋白酶处理后离心收集细胞沉淀。(在摇瓶中培养的单层贴壁细胞通常采用胰蛋白酶处理的方法。)
Ø 直接裂解法:确定细胞数量,彻底吸除细胞培养基上清,立即进行第 2 步裂解步骤。
Ø 胰蛋白酶处理法:确定细胞数量,吸除培养基,用 PBS 洗涤细胞,吸除 PBS,向细胞中加入含有0.10-0.25%胰蛋白酶的 PBS 处理细胞,当细胞脱离容器壁时,加入含有血清的培养基失活胰蛋白酶,将细胞溶液转移至RNase-Free 的离心管中,300×g 离心 5 min,收集细胞沉淀,仔细吸除所有上清。
注意:收集细胞时一定要将细胞培养液去除干净,否则会导致裂解不完全,影响 RNA 与吸附柱的结合, 造成RNA 的产量降低;请勿使用过多的样本量,避免管柱杜塞而造成 RNA 的产量降低。
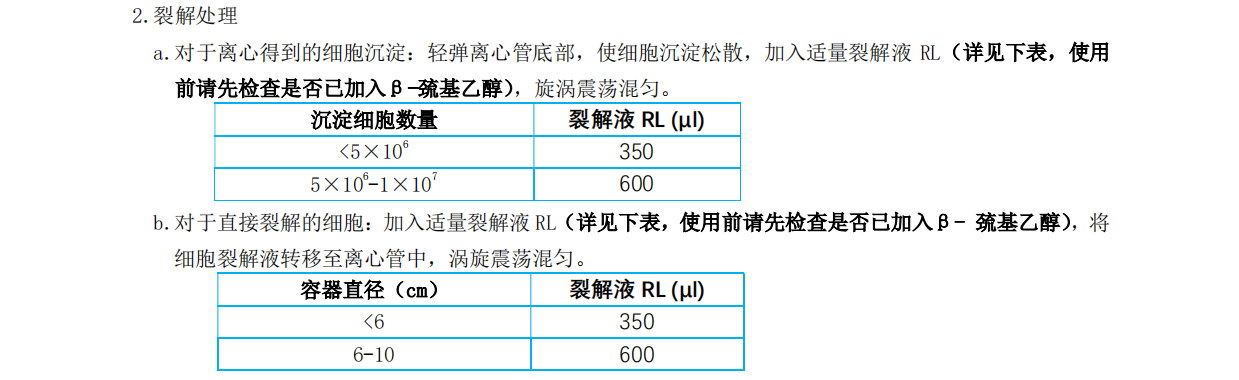
3. 将所有溶液转移至过滤柱 CS1 上(过滤柱 CS1 放在收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
4. 向滤液加入等体积 70%乙醇至裂解液中,混匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
二、从动物组织中提取总 RNA
1. 匀浆处理:
每 10-20 mg 组织加 300 μl 裂解液RL(使用前请先检查是否已加入 β-巯基乙醇),用研磨杵将组织彻底研磨(如组织较难彻底研磨,可选用电动或玻璃匀浆器);随后向匀浆液 中加入 590 μl RNase-Free ddH2O 和
10 μl Proteinase K(20mg/ml),混匀后 56℃处理 10-20 min。
注意:组织量一定不要超过 20 mg,否则将导致RNA 得率和质量下降。
2. 将裂解混合液转移至过滤柱 CS1(过滤柱 CS1 放入收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
3. 向滤液加入 0.5 倍上清体积的无水乙醇,均匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
三、从细菌中提取总RNA
1.4℃12,000 rpm(~13,400×g)离心 2 min 收集菌体(收集菌体的最大量不超过 1×109),仔细去除所有培养基上清,以后的所有离心步骤均在室温(20-25℃)进行。
注意:如果培养基上清去除不完全,将对第二步中的细胞壁消化过程产生抑制。
2. 用含有溶菌酶的 100μl TE 缓冲液(客户自己配制,配制方法见下表)彻底重悬菌体,孵育时间见下表。
|
|
TE 缓冲液中的溶菌酶终浓度 |
孵育时间(室温) |
|
G-细菌 |
400 μg/ ml |
3-5 min |
|
G+细菌 |
3 mg/ ml |
5-10 min |
3. 加入 350μl 裂解液 RL(使用前请先检查是否已加入β-巯基乙醇),涡旋振荡混匀。
4. 将裂解混合液转移至过滤柱 CS1 上(过滤柱CS1 放入收集管),12,000 rpm(~13,400×g)离心 2min,收集滤液。
5. 向滤液中加入 250μl 无水乙醇,混匀(此时可能会出现沉淀),转至后面“RNA 提取步骤”。
四、从植物组织中提取总 RNA
本试剂盒不适用于富含淀粉、酚类和次级代谢物的植物组织(例如一些木本植物,胚乳或丝状真菌的菌 丝体),因为 2-ME/裂解液在加入至样本粉末后,会变固态或非常粘稠,此类植物组织请使用“多糖多酚植物总RNA 提取kit”(货号 TR22)。
1. 匀浆处理
50-100 mg 植物叶片在液氮中迅速研磨成粉末,加入 450 μl RL(使用前请先检查是否已加入β-巯基乙醇),涡旋剧烈震荡混匀,并于 56℃孵育 3 分钟。
注意 1:在 56℃孵育 1-3 min 将有助于植物组织裂解,但是对于某些富含淀粉的样品,请不要加热处理, 防止因淀粉引起的样品膨胀现象。
注意 2:由于植物多样性非常丰富,而且同种植物的不同生长发育阶段和不同组织的 RNA 含量都不相同, 请根据具体实验情况选择合适的植物材料的用量。
2. 将所有溶液转移至过滤柱 CS1 上(过滤柱 CS1 放在收集管中),12,000 rpm(~13,400×g)离心 2-5 min,小心吸取收集管中的上清至RNase-Free 的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。
注意:由于裂解液较粘稠,所以将溶液转移至过滤柱时,可以剪去部分吸头末端。
3. 缓慢加入 0.5 倍上清体积的无水乙醇,混匀(此时可能会出现沉淀),转至“RNA 提取步骤”。
u RNA 提取步骤
此为续接样本制备“一、二、三、四、五”后的RNA 提取操作步骤。
1. 将前一步所得“裂解液/乙醇混合液”(含沉淀),移取至吸附柱 CR1 中(吸附柱 CR1 放入收集管中),12,000 rpm (~13,400×g )离心 30-60 sec,倒掉收集管中的废液,将吸附柱 CR1 放回收集管中。
注意:将溶液和沉淀转移至吸附柱CR1 时,如果体积大于吸附柱容量,可以分次完成。
2. 向吸附柱CR1 中加入 500ul 溶液RW,12,000 rpm (~13,400×g )离心离心 1 min,丢弃滤液,将吸附柱CR1 放回收集管中。
3. DNase Ⅰ降解。
每一纯化反应,请将 80 ul DNase 消化液与 2ul DNaseⅠ预先混合在新的离心管(轻弹或翻转离心管以混合均匀,请勿震荡),将 82 ul “DNaseⅠ工作液”加入至吸附柱的膜中心,于室温(25~28℃)孵育15 分钟。
注意:如同时操作多组样本,请使用前现配新鲜的 DNaseⅠ工作液,请勿预先配制保存 DNaseⅠ工作液。4.向吸附柱CR1 中加入 500μl 溶液RW,12,000 rpm(~13,400×g)离心 1 min,倒掉收集管中的废液,将吸
附柱CR1 放回收集管中。
5. 向吸附柱CR1 中加入 600μl 漂洗液 PW(使用前请先检查是否已加入乙醇),12,000 rpm(~13,400×g) 离心 1 min,倒掉收集管中的废液,将吸附柱CR1 放回收集管中。
6. 重复操作步骤 5。
7.12,000 rpm(~13,400×g)离心 3 min,将吸附柱CR1 置于室温放置数分钟,以彻底晾干吸附材料中残余的乙醇。
注意:此步骤目的是将吸附柱中残余的漂洗液去除,离心后将吸附柱 CR1 在室温放置片刻,以充分晾干。如果有漂洗液残留,可能会影响后续的 RT 等实验。
8. 将吸附柱CR1 转入一个新的 RNase-Free 离心管中,加入 30-100 μl 无酶双蒸水至吸附柱的膜中心,室温静置 2 min,12,000 rpm(~13,400×g)离心 1 min,得到 RNA 溶液。
注意:洗脱缓冲液体积不应少于 30 μl,体积过小影响回收效率;RNA 溶液请于-70℃保存。
 附录Ⅰ:从酵母菌中提取总 RNA
附录Ⅰ:从酵母菌中提取总 RNA
一、需要自备的试剂:
a.溶壁酶(Lyticase):目录号 GF0210-01 b.山梨醇 buffer:
用0.1M磷酸钠缓冲液(pH7.4)配制1.2 M山梨醇;
0.1M磷酸钠缓冲液(pH7.4)的配制:77.4 ml 0.1 mol/L Na2HPO4+ 22.6ml 0.1mol/L NaH2PO4
二、操作步骤
1. 取酵母细胞(最多不超过5×107cells),12,000 rpm(~13,400×g )离心1 min,尽量吸除上清(菌液较多时可以通过几次离心将菌体沉淀收集到一个离心管中)。
2. 酵母细胞壁的破除:
酶法:向菌体中加入1ml山梨醇buffer,加入大约50U Lyticase(需自备,我司目录号:GF0210-01)充分混匀,30℃孵育30min,300×g离心5 min,弃上清,收集沉淀。
注意:以上为5×107酵母细胞的Lyticase用量,根据酵母的菌株和酵母细胞数量的不同,所用Lyticase 的浓度和孵育时间应该进行适当调整。
3. 加入 350 μl 裂解液 RL(在使用前请加入 β-巯基乙醇),涡旋振荡混匀,将裂解混合液转移至过滤柱 CS1
上(过滤柱 CS1 放入收集管中),12,000 rpm(~13,400×g)离心 2min,收集滤液。
4. 向滤液中加入 350μl 70%乙醇,混匀(此时可能会出现沉淀),转至上面“RNA 提取步骤”。
 附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。
附录Ⅱ:RNA Clean -Up 或基因组 DNA 去除。
本试剂盒可用于将以其他方法提取的 RAN 进行clean up 或去除基因组DNA 污染。
1. 将RNA 以无酶水调整体积至 100ul,加入 350ul 的裂解液 RL(使用前请加入β 巯基乙醇),混合均匀。
2. 加入 250ul 的无水乙醇至裂解液中,混匀,转至上面“RNA 提取步骤”。
作者:Jianhong Zhou ,Lingzhou Zhao 影响因子:4.259
期刊:《Scientific Reports 6, Article number: 29069 (2016)》 PMID:27353337
| 用户名: | (可为空) |
| E-mail: | *(必填) |
| 评价等级: |





|
| 评论内容: |
*(必填)
|
 中文
中文 


