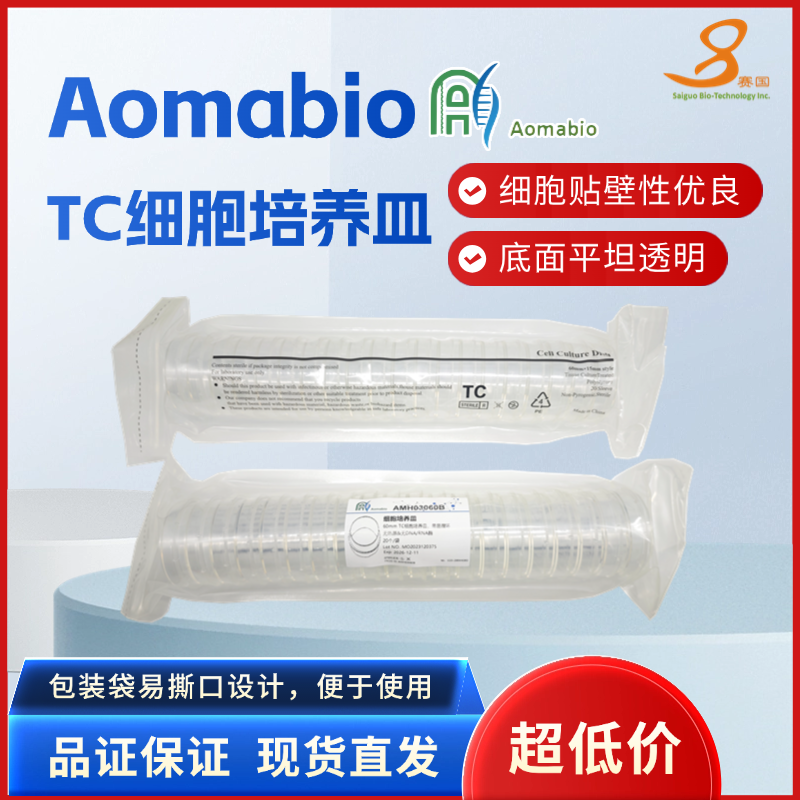
60mm TC细胞培养皿,袋装灭菌
基本售价:18.00元
细胞培养皿奥玛生物所有的培养皿均经过严格检测和认证,同时我们的培养皿由高度通透优质聚苯乙烯制造,合适常规和显微观察。产品特点l 全新的锯齿边缘设计方便使用者平稳拿取整个培养皿,或者将一个培养皿从堆叠的多个培养皿中取出l 底部平坦透明,显微镜下不会光学扭曲变形l 培养表面特殊 TC 处理,细胞贴壁性优良l 培养表面未作 TC 处理,适合悬浮细胞使用l 皿盖通气栅设计,确保气体交换l 无热原,无内毒素
35mm TC细胞培养皿,袋装灭菌
基本售价:13.00元
细胞培养皿奥玛生物所有的培养皿均经过严格检测和认证,同时我们的培养皿由高度通透优质聚苯乙烯制造,合适常规和显微观察。产品特点l 全新的锯齿边缘设计方便使用者平稳拿取整个培养皿,或者将一个培养皿从堆叠的多个培养皿中取出l 底部平坦透明,显微镜下不会光学扭曲变形l 培养表面特殊 TC 处理,细胞贴壁性优良l 培养表面未作 TC 处理,适合悬浮细胞使用l 皿盖通气栅设计,确保气体交换l 无热原,无内毒素
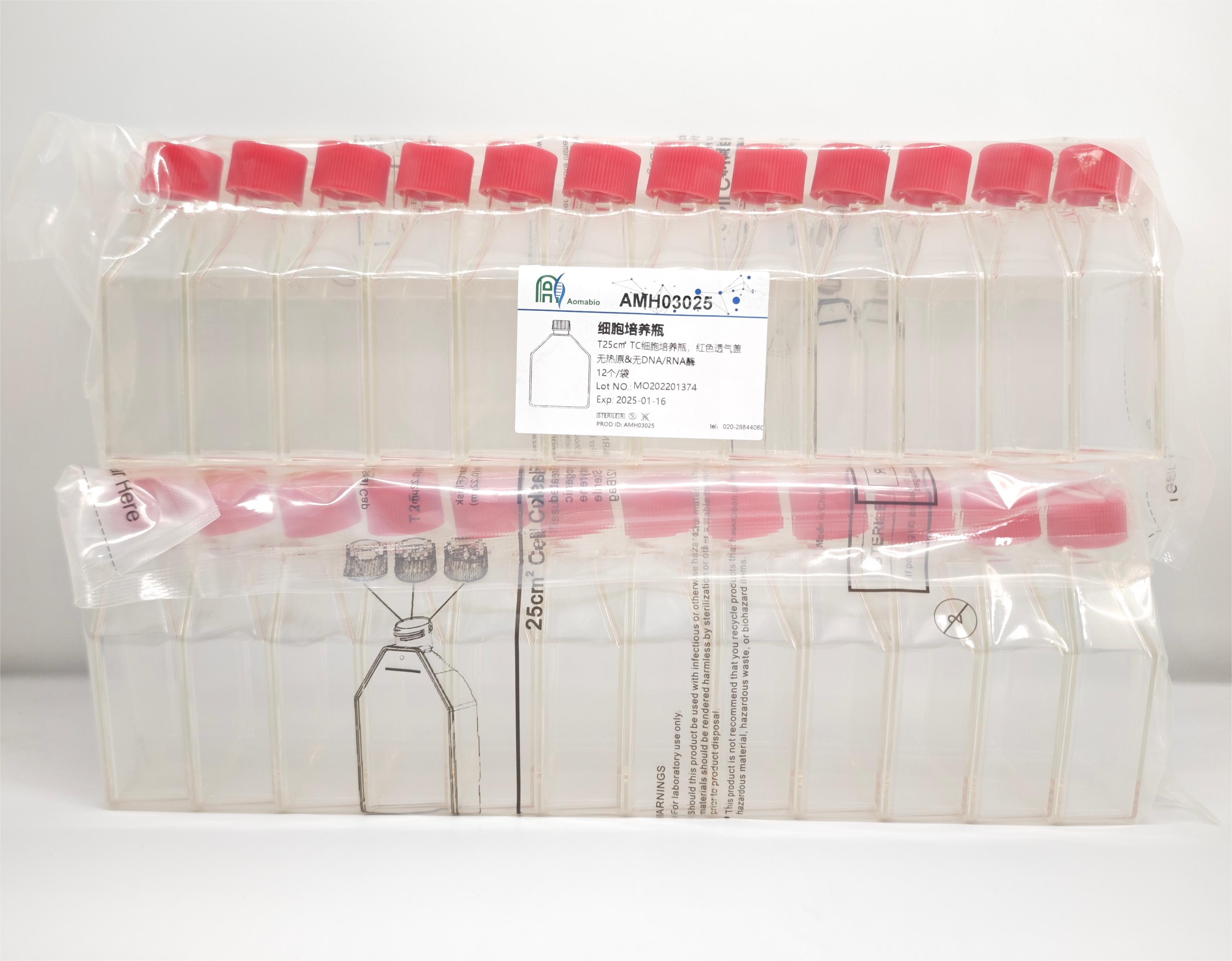
T25c㎡ TC细胞培养瓶,袋装灭菌,红色透气盖
基本售价:35.00元
细胞培养瓶所有不同规格的细胞培养瓶均分为不同的培养表面,通过盖子的颜色对表面快速明确辨认,红色为贴壁细胞,绿色为敏感贴壁细胞,白色为悬浮细胞,灰色为敏感悬浮细胞。产品特点l 无菌自封袋包装l 瓶颈两侧提供醒目书写区,两侧均印有刻度,使用方便l 瓶体防侧翻设计,降低污染危险。另外,堆垛边缘确保重叠放置的稳定性l 优化倾斜瓶颈和防滴流边缘,减少培养基溢出造成污染的危险,并且倾倒更安全l 细胞刮刀和血清移液管可以触及任意角落l 辐照灭菌、无热原、无内毒素、无细胞毒性

96孔TC平底细胞培养板,盒装灭菌
基本售价:6.00元
细胞培养板奥玛生物提供 6、12、24、48 和96 孔不同规格的细胞培养板。所有培养板均由高度通透的优质聚苯乙烯制造而成。细胞培养板的尺寸严格遵循 ANSI/SLAS 标准要求,可用于符合这一标准的仪器操作和分析使用。产品特点l 为了便于孔内加样,在凹槽边缘和培养孔间隙中标注有字母和数字l 独立式凹槽设计,减少移液污染危险l 底座防滑设计,有助于平稳取出整个培养板,通过透明的侧壁可以对孔内加样进行目测检查l 盖子内侧通风格和冷凝环设计,两者共同保证了稳定的气体交换,最大限度减少蒸发

2mL离心管,袋装不灭菌,透明
基本售价:50.00元
微量离心管奥玛微量离心管质量卓越,款式多样。作为实验室常规耗材,微量离心管原料采用符合 USP Class VI 标准的进口聚丙烯,不含重金属离子。产品特点l RCF:20000×gl 关闭方便,加强型宽盖子连接,可单手操作l 磨砂样品编号区,方便标记l 刻度线清晰,快速读数

0.2mL PCR8联排(含盖),透明(A款axygen同款)
基本售价:1000.00元
PCR八联排管少量体积样品反应的理想选择,适用于快速PCR反应,可以适配市面上主流的PCR/qPCR仪。产品特点l 联盖和 PCR 联管彼此适配,封密性好,防止污染且易于盖l 不会扭曲、弯曲或断裂,加固型联盖可防止 PCR 联管下垂l 孔壁薄,厚度均,热传递速度快,结果可靠,重复性强l 平盖能更好的配 合qPCR 实验l 无 DNase/RNase

100mm TC细胞培养皿,袋装灭菌
基本售价:338.00元
细胞培养皿奥玛生物所有的培养皿均经过严格检测和认证,同时我们的培养皿由高度通透优质聚苯乙烯制造,合适常规和显微观察。产品特点l 全新的锯齿边缘设计方便使用者平稳拿取整个培养皿,或者将一个培养皿从堆叠的多个培养皿中取出l 底部平坦透明,显微镜下不会光学扭曲变形l 培养表面特殊 TC 处理,细胞贴壁性优良l 培养表面未作 TC 处理,适合悬浮细胞使用l 皿盖通气栅设计,确保气体交换l 无热原,无内毒素
T25c㎡ TC细胞培养瓶,袋装灭菌,红色透气盖
基本售价:845.00元
细胞培养瓶所有不同规格的细胞培养瓶均分为不同的培养表面,通过盖子的颜色对表面快速明确辨认,红色为贴壁细胞,绿色为敏感贴壁细胞,白色为悬浮细胞,灰色为敏感悬浮细胞。产品特点l 无菌自封袋包装l 瓶颈两侧提供醒目书写区,两侧均印有刻度,使用方便l 瓶体防侧翻设计,降低污染危险。另外,堆垛边缘确保重叠放置的稳定性l 优化倾斜瓶颈和防滴流边缘,减少培养基溢出造成污染的危险,并且倾倒更安全l 细胞刮刀和血清移液管可以触及任意角落l 辐照灭菌、无热原、无内毒素、无细胞毒性

96孔TC平底细胞培养板,盒装灭菌
基本售价:270.00元
细胞培养板奥玛生物提供 6、12、24、48 和96 孔不同规格的细胞培养板。所有培养板均由高度通透的优质聚苯乙烯制造而成。细胞培养板的尺寸严格遵循 ANSI/SLAS 标准要求,可用于符合这一标准的仪器操作和分析使用。产品特点l 为了便于孔内加样,在凹槽边缘和培养孔间隙中标注有字母和数字l 独立式凹槽设计,减少移液污染危险l 底座防滑设计,有助于平稳取出整个培养板,通过透明的侧壁可以对孔内加样进行目测检查l 盖子内侧通风格和冷凝环设计,两者共同保证了稳定的气体交换,最大限度减少蒸发

2mL离心管,袋装不灭菌,透明
基本售价:439.00元
微量离心管奥玛微量离心管质量卓越,款式多样。作为实验室常规耗材,微量离心管原料采用符合 USP Class VI 标准的进口聚丙烯,不含重金属离子。产品特点l RCF:20000×gl 关闭方便,加强型宽盖子连接,可单手操作l 磨砂样品编号区,方便标记l 刻度线清晰,快速读数

3mL巴氏吸管
基本售价:159.00元
巴氏吸管巴氏吸管是巴斯德吸管的别称、转液管,由透明高分子聚乙烯 (LDPE) 材料制作而成。细胞试验、临床试验、克隆试验等少量液体的吸取、转移或携带等操作相对于玻璃材质,能够降低细胞和蛋白的吸附损耗。塑料材质不易碎,同时消除使用时受伤或感染的风险。可进行热密封,以便密封运输或储存。一体化设计,免去了插入或移除橡胶洗耳球的麻烦,提高效率。 产品特点l 弹性吸囊,适用于快速移液l 管体柔软,可从狭小或弯曲容器中进行吸取操作l 无 DNase/RNase,无热原,无内毒素,无溶血性l 使用方便,精准度良好,刻度线清晰,便于观察l 管壁流动性好,壁厚均匀,不易损坏
0.2mL PCR单管,平盖,透明
基本售价:591.00元
PCR单管在不影响操作的情况下提高了安全性,防污染保护设计,避免意外触碰密封盖内侧。产品特点l 扁平密封盖,文字标记区域较大l 管壁光滑且纤薄,确保样品间热传导的有效性和均一性l 在使用热盖的情况下,反应体积损失在 0.5% 以下l 无 DNase/RNase,无抑制剂污染
200μL吸头,袋装不灭菌,黄色
基本售价:591.00元
通用袋装吸头奥玛独特设计的通用移液器吸头,采用进口聚丙烯(PP)材料生产,产品性能优越,可以匹配多种品牌的单通道和多通道移液器。通用移液器吸头是最为常见的一类吸头,也是应用最为广泛的吸头,几乎所有移液操作都可使用,这是吸头中最经济实惠的一类,如果没有特殊的要求,一般使用标准吸头即可满足大部分的移液需求。 产品特点 l 通用广泛,适配主流移液器l 特制滤芯能有效避免吸头在使用过程中因样品挥发形成气溶胶而导致的样品间的交叉污染l 超精密打磨成型技术,内壁光滑,移液精准,密封兼容性更好l 透明度高,刻度清晰,便于观察l 耐受性强,-80℃ ~121℃的耐受范围,高温高压后不变形l 无热原、无内毒素、无 DNase/RNase
0.5-10μL吸头,袋装不灭菌,透明
基本售价:507.00元
通用袋装吸头奥玛独特设计的通用移液器吸头,采用进口聚丙烯(PP)材料生产,产品性能优越,可以匹配多种品牌的单通道和多通道移液器。通用移液器吸头是最为常见的一类吸头,也是应用最为广泛的吸头,几乎所有移液操作都可使用,这是吸头中最经济实惠的一类,如果没有特殊的要求,一般使用标准吸头即可满足大部分的移液需求。 产品特点 l 通用广泛,适配主流移液器l 特制滤芯能有效避免吸头在使用过程中因样品挥发形成气溶胶而导致的样品间的交叉污染l 超精密打磨成型技术,内壁光滑,移液精准,密封兼容性更好l 透明度高,刻度清晰,便于观察l 耐受性强,-80℃ ~121℃的耐受范围,高温高压后不变形l 无热原、无内毒素、无 DNase/RNase
1250ul吸头,袋装不灭菌,蓝色
基本售价:240.00元
通用袋装吸头奥玛独特设计的通用移液器吸头,采用进口聚丙烯(PP)材料生产,产品性能优越,可以匹配多种品牌的单通道和多通道移液器。通用移液器吸头是最为常见的一类吸头,也是应用最为广泛的吸头,几乎所有移液操作都可使用,这是吸头中最经济实惠的一类,如果没有特殊的要求,一般使用标准吸头即可满足大部分的移液需求。 产品特点 l 通用广泛,适配主流移液器l 特制滤芯能有效避免吸头在使用过程中因样品挥发形成气溶胶而导致的样品间的交叉污染l 超精密打磨成型技术,内壁光滑,移液精准,密封兼容性更好l 透明度高,刻度清晰,便于观察l 耐受性强,-80℃ ~121℃的耐受范围,高温高压后不变形l 无热原、无内毒素、无 DNase/RNase

通用型抗体稀释液
基本售价:790.00元
产品介绍:通用型抗体稀释液是一种即用型的,适合于稀释所有免疫抗体测定(Immunofluorescence, IHC, ELISA, WB)实验中的抗体。该试剂可用于一抗或二抗的稀释和配制,在4℃保存和使用不少于六个月。稀释液中加入了多种抗体结合反应增强剂及稳定剂,能够增加抗体的溶解度和稳定性,增强免疫反应,降低非特异的背景颜色,提高实验的特异性和灵敏度。可反复使用,节约宝贵的抗体。试剂中不含有动物源的蛋白、磷酸盐、叠氮钠或硫柳汞类防腐剂,适合于所有类型抗体稀释,包括HRP,AP标记的抗体。产品特色:1.即用型稀释液,无需配制2.稀释后的抗体可以使用长达6个月3.适用所有实验的抗体稀释(IF、IHC、ELISA、WB)4.含抗体结合反应增强剂、稳定剂,效果更佳5.不含 BSA、脱脂奶粉等动物源蛋白6.不含磷酸盐、叠氮钠或硫柳汞类防腐剂 运输和保存条件:常温运输,4℃存储,有效期两年。使用说明:1.根据抗体使用说明书,直接用本品对一抗或二抗进行适当倍数的稀释。2.保存在抗体稀释液中的抗体可回收于4℃保存,可反复使用多次,长达6 个月以上,直至不能达到理想结果后丢弃。注意事项:1.使用后请旋紧瓶盖,防止溶液挥发或与空气的物质发生化学反应,并放回4℃保存。2.在进行抗体免疫反应前可以使用Genefist的无蛋白封闭液(货号GF1813)进行封闭,能进一步提高条带的清晰度,减少显色后的高背景和杂带的产生 。3.本品不含叠氮钠或硫柳汞类防腐剂,但含安全性更高的防腐剂,还需小心操作避免皮肤直接接触。4. 本试剂只能用于科研实验,请勿用于临床诊断和其它用途。

5X蛋白上样缓冲液(还原型)
基本售价:50.00元
产品简介: SDS-PAGE 上样缓冲液(SDS-PAGE Loading Buffer, 5X),是一种经过改良的以溴酚蓝为染料,5 倍浓缩的蛋白上样缓冲液,用于 SDS-PAGE 时蛋白样品的上样操作。本产品不含传统的 β-巯基乙醇或 DTT,采用 TCEP作为还原剂,稳定性更好、还原效果更高,并且无难闻气味!由于含有变性剂,本产品不适用于非变性胶的电泳。 保存条件: -20℃保存,至少两年有效。 使用说明: 1、 在 37℃水浴中溶解蛋白上样缓冲液。 注意: Loading buffer 里含有大量甘油,有助于样品沉淀至加样孔底部,低温下试剂组分在甘油里容易析出,使用前一定要确保蛋白上样缓冲液充分溶解。 2、 按照每 4ul 蛋白样品加入 1ul 上样缓冲液的比例,混合蛋白样品和上样缓冲液。 3、 100℃或沸水浴加热 5-10 分钟,以充分变性蛋白。 注意:如果起始时细胞或组织的用量较大,基因组 DNA 含量较高,煮沸 5-10 分钟后有可能仍然比较粘稠或者有粘稠状的半透明物体,此时需要延长煮沸时间,或者加入适量稀释成 1X 的蛋白上样缓冲液再煮 3-5 分钟。充分煮沸可以使结合在基因组 DNA 上的蛋白充分释放,同时会导致基因组 DNA 的部分断裂,从而使粘稠感消失,这样就不会影响后续的上样操作。 4、 冷却到室温后,离心取上清上样到 SDS-PAGE 胶加样孔内,开始电泳。 5、 通常电泳至蓝色染料到达胶的底端处附近,即可停止电泳。 注意事项: 由于含有变性剂,本品不适用于非变性胶的电泳 SDS-PAGE 蛋白上样缓冲液(5X)必须完全溶解后再使用。 本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗。 为了您的安全和健康,请穿实验服并戴一次性手套操作。
 中文
中文 

